Antes de entrarmos no assunto de forças intermoleculares (entre moléculas), é preciso ter em mente o que são as forças intramoleculares (dentro das moléculas, ou seja, entre os átomos) e alguns conceitos sobre estados físicos da matéria. As forças intramoleculares são chamadas de ligações, ou seja, são as ligações covalente (polar e apolar); as ligações iônicas são forças eletrostáticas entre íons. No resumo das forças, ainda neste artigo, é possível ver esta última, listada junto com as outras forças intermoleculares. Já os conceitos sobre os estados físicos da matéria são discutidos nas imagens abaixo.
 |
| Observação: Quanto menos intensas forem as forças intermoleculares, mais volátil será a substância e menor será a sua temperatura de ebulição. |
Forças
intermoleculares são muito mais fracas do que as forças
intramoleculares (por exemplo, 16 kJ mol^-1 versus 431 kJ mol^-1 para
o HCl). Quando uma substância funde ou entra em ebulição, essas
forças intermoleculares são quebradas e as moléculas são
separadas. Já quando uma substância passa de gás para líquido ou
sólido, as moléculas são reaproximadas e as ligações
intermoleculares restabelecidas.
π-π Stacking:
Forças íon-dipolo:π-π Stacking:
Em química, pi stacking ou π–π stacking se refere a uma atração, não covalente entre anéis aromáticos. Stacking em tradução livre significa empilhamento. Essas interações são importantes na organização das moléculas de DNA e de RNA, tais como a dobra das proteínas e reconhecimento molecular, embora algumas novas pesquisas estejam começando a sugerir que o pi stacking pode não operar em algumas dessas aplicações.

Apesar de todos os experimentos e do interesse teórico, ainda não existe uma descrição unificada sobre os fatores que contribuem para as interações pi stacking.
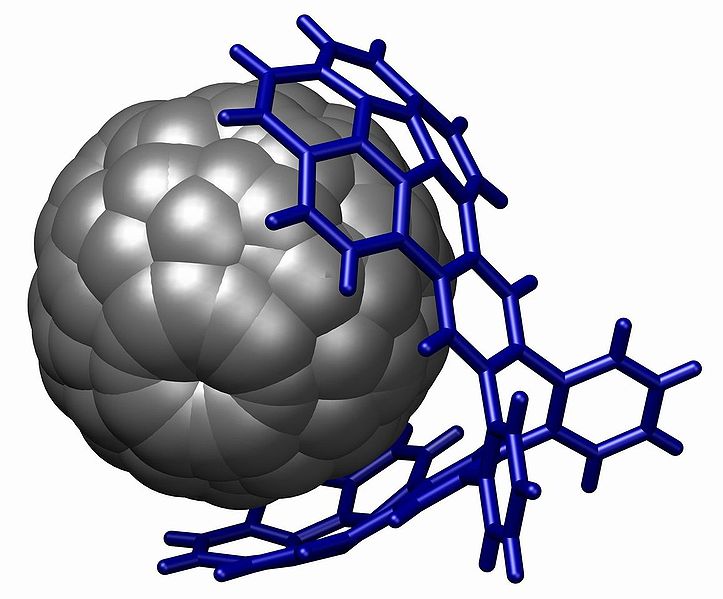
Um dos exemplos mais famosos é o fulereno e o "buckycatcher", em referência a uma luva apanhando uma bola de beisebol. Essa "luva" ou "pinça" molecular é baseada em duas "buckybowls" côncavas com uma perfeita combinação para com uma molécula de fulereno convexa.

Apesar de todos os experimentos e do interesse teórico, ainda não existe uma descrição unificada sobre os fatores que contribuem para as interações pi stacking.

Um dos exemplos mais famosos é o fulereno e o "buckycatcher", em referência a uma luva apanhando uma bola de beisebol. Essa "luva" ou "pinça" molecular é baseada em duas "buckybowls" côncavas com uma perfeita combinação para com uma molécula de fulereno convexa.
É a interação entre
um íon e um dipolo e é a mais forte de todas as forças
intermoleculares. Um exemplo é a dissolução do sal em água.
Basicamente, os dipolos são criados por certos átomos dentro de moléculas que distorcem a nuvem eletrônica das mesmas, por serem mais eletronegativos (capacidade de um átomo em atrair elétrons para si em uma ligação química) que os átomos que estão ligados.
 Forças de Van der Waals:
Forças de Van der Waals:
Inclui as forças
dipolo-dipolo, de London (dipolos induzidos ou dipolos instantâneos)
e a ligação de hidrogênio. Essas são as forças intermoleculares
clássicas que também são chamas de forças de Van der Waals em
homenagem ao físico holandês Johannes Van der Waals (1837-1923),
que, em 1873, propôs a existência dessas forças.
Um fato interessante é que, em 2002, uma equipe multidisciplinar de cientistas de quatro universidades do estado americano da Califórnia publicou na revista Proceedings of the National Academy of Sciences o resultado de anos de pesquisa, que confirma a força de Van der Waals como a responsável pela capacidade das lagartixas em escalar praticamente qualquer superfície através da interacção de tais forças entre a superfície e as patas do animal.
Ocorre entre moléculas
polares neutras.
Se duas moléculas têm
aproximadamente a mesma massa e o mesmo tamanho, as forças
dipolo-dipolo aumentam com o aumento da polaridade.
Forças de Van der Waals: Forças de Dispersão de London ou Dipolos Induzidos.
É a mais fraca de
todas as forças intermoleculares. O que acontece nesse tipo de
interação é que o núcleo de uma molécula (ou átomo) atrai os
elétrons de uma molécula adjacente (ou átomo). Por um instante, as
nuvens eletrônicas ficam distorcidas e forma-se um dipolo
(denominado dipolo instantâneo, induzido ou temporário).
Alguns pontos
importantes a se observar são os seguintes:
- As forças de dispersão de London aumentam à medida que a massa molecular aumenta.
- Existem forças de dispersão de London entre todas as moléculas, mas é o único tipo de interação entre moléculas apolares.
- As forças de dispersão de London dependem da forma da molécula.
- Quanto maior for a área de superfície disponível para contato, maiores são as forças de dispersão.
- As forças de dispersão de London entre moléculas esféricas são menores do que entre as moléculas com formato de linear (n-pentano e neo-pentano).
 |
| N-pentano: IUPAC = pentano. Neopentano: IUPAC = dimetil propano. |
Ligação de Hidrogênio:
 Tensão superficial é um efeito físico que ocorre na camada superficial de um líquido que leva a sua superfície a se comportar como uma membrana elástica. As moléculas situadas no interior de um líquido são atraídas em todas as direções pelas moléculas vizinhas e, por isso, a resultante das forças que atuam sobre cada molécula é praticamente nula. As moléculas da superfície do líquido, entretanto, sofrem apenas atração lateral e inferior. Conseqüentemente, as moléculas da
superfície estão mais densamente empacotadas do que as outras
moléculas.
Tensão superficial é um efeito físico que ocorre na camada superficial de um líquido que leva a sua superfície a se comportar como uma membrana elástica. As moléculas situadas no interior de um líquido são atraídas em todas as direções pelas moléculas vizinhas e, por isso, a resultante das forças que atuam sobre cada molécula é praticamente nula. As moléculas da superfície do líquido, entretanto, sofrem apenas atração lateral e inferior. Conseqüentemente, as moléculas da
superfície estão mais densamente empacotadas do que as outras
moléculas.
_________________________________________
A ligação de
hidrogênio é um caso especial de forças dipolo-dipolo. É uma
forma de explicação dos pontos de ebulição anomalamente altos de substâncias que
possuem o hidrogênio interagindo com um átomo muito eletronegativo.
Como regra geral, esses átomos são o “FON” (flúor, oxigênio e
nitrogênio).
Essa força
intermolecular é tão mais forte que as outras que chega a ser
chamada de “ligação”, embora também seja encontrada nomeada
como “ponte de hidrogênio”, mas este termo tem caído em desuso.
Os elétrons em H-X (X
= elemento muito eletronegativo) se encontram MUITO mais próximos do
elemento X do que do hidrogênio, este, por sua vez, fica com carga
parcial positiva e com um próton praticamente descoberto. Devido a
esse fato, explica-se a força desse caso especial.
Flutuação do Gelo:
Os sólidos são
normalmente mais unidos do que os líquidos, portanto, os sólidos
são mais densos. Entretanto, o gelo é ordenado com uma estrutura
aberta para otimizar a ligação de hidrogênio. Consequentemente, o
gelo é menos denso do que a água. Na água, o comprimento da
ligação H-O é 1,0 Å e o comprimento da ligação de hidrogênio
O...H é 1,8 Å.
Agora, no final do artigo e partindo para o resumo, é importante ressaltar algumas das
propriedades explicadas pelas forças intermoleculares. Essas propriedades são a
viscosidade e a tensão superficial.
Viscosidade:
Viscosidade é a
resistência de um líquido em fluir. Um líquido flui através do
deslizamento das moléculas sobre outras. Portanto, quanto mais
fortes são as forças intermoleculares, maior é a viscosidade.
Tensão Superficial:
 Tensão superficial é um efeito físico que ocorre na camada superficial de um líquido que leva a sua superfície a se comportar como uma membrana elástica. As moléculas situadas no interior de um líquido são atraídas em todas as direções pelas moléculas vizinhas e, por isso, a resultante das forças que atuam sobre cada molécula é praticamente nula. As moléculas da superfície do líquido, entretanto, sofrem apenas atração lateral e inferior. Conseqüentemente, as moléculas da
superfície estão mais densamente empacotadas do que as outras
moléculas.
Tensão superficial é um efeito físico que ocorre na camada superficial de um líquido que leva a sua superfície a se comportar como uma membrana elástica. As moléculas situadas no interior de um líquido são atraídas em todas as direções pelas moléculas vizinhas e, por isso, a resultante das forças que atuam sobre cada molécula é praticamente nula. As moléculas da superfície do líquido, entretanto, sofrem apenas atração lateral e inferior. Conseqüentemente, as moléculas da
superfície estão mais densamente empacotadas do que as outras
moléculas. |
| O fenômeno de tensão superficial da água explica por que alguns insetos são capazes de andar sobre sua superfície. |
Referências:
Slide do Prof. Glaucio B. Ferreira - Instituto de Química (UFF). Aula de Química Geral de 2013.1, Ligações Químicas.
Slide do Prof. Glaucio B. Ferreira - Instituto de Química (UFF). Aula de Química Geral de 2013.1, Ligações Químicas.
![[feature]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEiFb20w9mskprNMMsygC0dDfp4e5-6HcPjS0iZwdMDKD9rGrFSzPzWKGP7zchYZDH_FZWKFcyamkNxX6LJaPnocCpUbVI81aPr2wl618vHC6RkCuh_UQ9KzilZ6njKbfEz5TT7AfPCJAeb5O7oMLFn3_FJsHgppFK6p7rTWBF79j2naGhkH0XY9IU1cBA/s16000/for%C3%A7as%20inter.png)






